FASA KESETIMBANGAN
I. Tujuan
Percobaan
Setelah melakukan percobaan ini,
mahasiwa mampu:
a.
Menjelaskan pengertian kurva baku
dan kirva kesetimbangan.
b.
Membuat campuran biner untuk kurva
baku.
c.
Menggambarkan kurva baku.
d.
Melaksanakan praktikum untuk memperoleh
data yang diperlukan.
e.
Menghitung guna mengolah data yang
diperoleh.
f.
Menggambarkan kurva kesetimbangan
berdasarkan hasil peehitungan.
II. Alat dan
Bahan
a.
Alat yang Digunakan
1.
Refraktometer
2.
Pipet ukur
3.
Bola karet
b.
Bahan yang digunakan
1.
Etanol
2.
Metanol
3. Aquadest
III. Dasar Teori
a.
Fasa Kesetimbangan
Fasa
kesetimbangan umumnya adalah dasar teori dan praktek pokok-pokok pemisahan
panas.Tanpa mengenal hukum dasar untuk pemisahan campuran biner.Maka tidak akan
mungkin mengerti rektifikasi atau distilasi Azootrop.
Bila suatu
campuran dipisahkan dengan menggunakan proses termal, panas dan zat biasanya
dipindahkan diantara fasa yang saling kontak satu sama lain. Suatu fasa
ditentukan sebagai bagian dari suatu sisstem fasa. Suatu sistem dikatakan
setimbang bial tidak ada perubahan yang terjadi pada kondisi eksternal.
Semua perpindahan zat dan energi melalui lapisan reversible phase. Fasa dari
suatu campuran heterogeneous dikatakan setimbang bila tidak ada perbedaan
tekanan maupun temperatur.
b. Skema
Gambaran dari Fasa Kesetimbangan
Fasa
kesetimbangan biasanya sifat-sifat dari komposisi fasa kesetimbangan oleh
sejumlah zat (fraksi mol) dengan titik didih yang rendah. Pada waktu ti,
nilai Xi , Yi , Ti dan Pi berubah
diperoleh, tergantung kesetimbangan.
c. Percobaan Penentuan Data Kesetimbangan
Bila
suatu campuran bersifat ideal,Yi bisa dihitung jika kurva dan tekanan uap
komponen murni Xi diketahui.Penggunaan hukum Renault untuk campuran gas ideal
adalah :
P1 = P1,0 . X1
............................................................... ..(Pers.1)
P2 = P2,0 . X2
..................................................................(Pers.2)
Ket
:
P1,P2
= Tekanan Parsial
P10,P20 = Tekanan uap partisi
X1,X2
= Fraksi mol dari
liquid
Dengan
menggunakan hukum dalton
P
tot = P1 +P2
Substitusi
persamaan 1 dan 2 kedalam persamaan (3)
P
tot = P1,0 . X1 + P2,0 . X2
Ptot
= P1,0 – P2,0 . X1 + P2,0
Susun
kembali persamaan 4,maka diperoleh :
IV. Dasar Teori Tambahan
a. Kesetimbangan
Kesetimbangan
memberikan pengertian bahwa suatu keadaan dimana tidak terjadi perubahan sifat makroskopis dari sitstem
terhadap waktu. Semakin dekat keadaan sistem dengan titik kesetimbanga, maka
semakin kecil gaya penggerak proses, semakin kecil pula laju proses dam
akhirnya sama dengan nol bila titik kesetimbangan telah tercapai.Seperti kesetimbangan pada umumnya, kesetimbangan
uap-cair dapat ditentukan ketika ada variabel yang tetap (konstan) pada suatu
waktu tertentu. Saat kesetimbangan ini, kecepatan antara molekul-molekul
campuran yang membentuk fase uap sama dengan kecepatan molekul-molekulnya
membentuk cairan kembali.
b. Tekanan parsil, hukum-hukum Dalton, Roult dan Henry
Tekanan parsil PA
komponen A di dalam suatu campuran uap adalah sama dengan tekanan yang akan
ditimbulkan oleh komponen A tersebut jika ditempatkan sendiri di dalam volume
dan temperatur yang sama dengan campuran. Menurut hukum Dalton, yaotu tekanan
total adalah sama dengan penjumlahan tekanan parsil. Untuk suatu gas (uap)
ideal, tekanan parsil berbanding lurus dengan fraksi mol konstituen. Untuk
suatu campuran ideal, tekanan parsil konstituen dikaitkan dengan konsentrasi
konstituen di dalam fasa cair , dimana Roult yang merumuskan hukum tersebut.
Sedangkan untuk XA dengan harga yang rendah , hubungan linier antara
PA dan XA dirumuskan dengan menggunakan
faktor perbandingan yaitu suatu konstanta Henry H’ dan bukan tekanan uap murni
zat.
Jika suatu
campuran mengikuti hukum Roult, maka tekanan uap campuran dapat diperoleh
secara grafik dengan memanfaatkan data tekanan uap masing-masing komponen. Bila
suatu campuran mengikuti hukum Roult, maka harga-harga YA untuk
berbagai komposisi XA dapat dihitung berdasarkan tekanan uap
masing-masing kedua komponen.
c. Kriteria kesetimbangan
Kriteria
kesetimbangan antar fasa ditinjau dari segi kemungkinan perpindahan antar fasa
tersebut. Dimisalkan bahwa sistem multi komponen yang tertutup terdiri dari
sejumlah fasa mempunyai temperatur dan tekanan yang uniform, akan tetapi pada
keadaan awal tidak seimbang ditinjauh dari segi perpindahan massa. Setiap
perubahan yang terjadi mesti bersifat irreversible, yang mendekatkan sistem itu
ke keadaan setimbang. Sistem itu dibayangkan sebagai dikelilingi keadaan yang
selalu setimbang secara thermal dan mekanikal dengan sistem itu (seklipun
perubahan terjdi dalam sisitem). Karenanya pertukaran panas dan pemuain kerja
antar sistem dan sekeliling terjadi secara reversible. Dalam keadaan yang
demikian perubahan entropi dari sekeliling sistem.
Fasa
Fasa adalah
bagian sistem dengan komposisi kimia dan sifat – sifat fisik seragam, yang terpisah
dari bagian sistem lain oleh suatu bidang batas. Pemahaman perilaku fasa mulai
berkembang dengan adanya aturan fasa Gibbs. Untuk sistem satu komponen,
persamaan Clausius dan Clausisus – Clapeyron menghubungkan perubahan tekanan
kesetimbangan dengan perubahan suhu.Sedangkan pada sistem dua komponen, larutan
ideal mengikuti hukum Raoult. Larutan non elektrolit nyata (real) akan
mengikuti hukum Henry.
Sistem Satu
Komponen
1. Aturan Fasa Gibbs
Pada tahun 1876, Gibbs menurunkan hubungan
sederhana antara jumlah fasa setimbang, jumlah komponen, dan jumlah besaran
intensif bebas yang dapat melukiskan keadaan sistem secara lengkap.
Bila suatu zat berada dalam
kesetimbangan, jumlah komponen yang diperlukan untuk menggambarkan sistem akan
berkurang satu karena dapat dihitung dari konstanta kesetimbangan. Misalnya
pada reaksi penguraian H2O.
Dengan menggunakan perbandingan pada persamaan 3.2,
salah satu konsentrasi zat akan dapat ditentukan bila nilai konstanta
kesetimbangan dan konsentrasi kedua zat lainnya diketahui.Kondisi fasa – fasa
dalam sistem satu komponen digambarkan dalam diagram fasa yang merupakan plot
kurva tekanan terhadap suhu.
Titik A pada kurva menunjukkan
adanya kesetimbangan antara fasa – fasa padat, cair dan gas. Titik ini disebut
sebagai titik tripel. Untuk
menyatakan keadaan titik tripel hanya dibutuhkan satu variabel saja yaitu suhu
atau tekanan. Sehingga derajat kebebasan untuk titik tripel adalah nol. Sistem
demikian disebut sebagai sistem invarian.
V. Langkah Kerja
a. Minggu ke-1
-
Menyiapkan alat refraktometer.
-
Memasukkan 4,5 mL air aquadest ke dalam tabung reaksi dan menambahakan 0,5
mL alkohol 98%.
-
Mengecek/melihat indeks bias campuran tersebut.
-
Melakukan hal yang sama dengan jumlah antara air aquadest dan alkohol 96%
sebesar 5 mL dan rentang volume masing-masing sebesar 0,5 mL (misalnya:
air aquadest 1 mL dan alkohol 96% 4,0 mL , dst).
-
Mengecek indeks bias air aquadest dan alkohol 96% murni.
b. Minggu ke-2
-
Memasukkan aquadest ke dalam gelas kimia sebanyak 41,6 mL
-
Menambahkan alkohol sebanyak 133,4 mL
-
Mengisi bejana dengan campuran air dan alkohol tersebut serta menambahkan
beberapa batu didih.
-
Menghidupkan cooler
-
Menyalakan komputer dan CASSY board
-
Memanggil program CASSY dengan double klik pada icon CASSY LAB
-
Membuka program RECTIFICATION, maka CASSY akan membaca temperatur
-
Menyalakan pemanas pada bejana
-
Memulai percobaan dengan menekan icon CLOCK sekaligus mencatat perubahan
suhu selama proses
-
Mengambil fasa uap dan cair yang telah dihasilkan setelah suhu konstan
(sekitar 70oC ke atas)
-
Mengukur indeks bias kedua fasa tersebut.
VIII. Analisa Percobaan
Setelah melakukan praktikum diatas, dapat dianalisa bahwa pada minggu pertama
dilakukan pengecekan indeks bias dari campuran biner (etanol-air) dan
(metanol-air) dengan konsentrasi alkohol dan air yang berbeda-beda. Dimana
semakin banyak konsentrasi air dalam campuran , maka semakin kecil indeks
biasnya karena mendekati indeks bias aquadest. Hal ini dapat digunakan untuk
membuat kurva baku yang digunakan untuk mencari fraksi mol alkohol fasa cair
dan fasa gas dalam umpan. Kemudian pada minggu kedua dilakukan proses destilasi
untuk memisahkan campuran alkohol-air dan menentukan indeks bias pada fasa uap
dan fasa cair ketika temperatur konstan (mencapi kesetimbangan).
Dari
data dapat terlihat bahwa semakin besar fraksi mol alhokol, maka semakin besar
indeks biasnya. Kurva baku ini dapat menentukan fraksi mol uap dan cair yang
akan mempengaruhi konstanta kesetimbangan (k) dimana semakin rendah temperatur
maka konstanta kesetimbangan k akan semakin kecil. Pada praktikum ini banyak
sekali faktor-faktor yang mempengaruhi, diantaranya: temperatur operasi,
komposisi alkohol dalam umpan, ketelitian dalam pembacaan indeks bias dan
lain-lain. Pada pengukuran indeks bias cair dan uap didapatkan indesk bias yang
kecil pada fasa uap. Hal ini dapat terjadi dikarenakan kurang
telitinya/kesalahan saat pembacaan pada alat refraktometer, pengambilan sampel
uap yang kurang baik, kecepatan dalam pengukuran (pembacaan indeks bias) yang
kurang baik karena cepat menguap dan sebagainya.
IX. Kesimpulan
Dari percobaan yang dilakukan dapat
disimpulkan bahwa :
-
Persamaan yang diperoleh dari kurva baku , yaitu : y = 0,021 x + 1,342
-
Semakin besar komposisi umpan, maka semakin menurun temperatur
kesetimbangan, sedangkan fraksi mol alkohol dalam fasa cair dan uap akan
meningkat.
-
Faktor-faktor yang mempengaruhi : temperatur operasi, komposisi umpan,
ketelitian dalam melihat indeks bias, efisiensi alat dan lain-lain.
Daftar Pustaka
Jobsheet. 2015 .”Penuntun Praktikum
Hidrokarbon”. Politeknik negeri Sriwijaya.2016
Palembang.

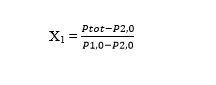


No comments:
Post a Comment